Natureza Ondulatória da Luz e os Espectros Atômicos.
Natureza Ondulatória da Luz e os
Espectros Atômicos.
Sabemos que os átomos são basicamente
constituídos de prótons, elétrons e nêutrons, que são chamados de partículas
fundamentais da estrutura de um átomo.
Ao estudarmos a história da evolução
dos modelos atômicos, de Dalton à Rutherford, podemos compreender como essas
partículas fundamentais foram descobertas. Um estudo mais aprofundando da
estrutura atômica nos permitirá entender como essas partículas se comportam, em
especial, o comportamento dos elétrons ao redor núcleo atômico.
Natureza Ondulatória da Luz.
Para investigar a estrutura interna
dos átomos, é necessário estudá-los ou observá-los indiretamente a partir das
propriedades da luz que eles emitem.
Os átomos quando estimulados por uma fonte de calor ou por uma descarga elétrica, emitem luz. Assim, para
entendermos a estrutura eletrônica dos átomos devemos primeiro compreender a
natureza da luz.
A luz, é um tipo de radiação eletromagnética, consiste em campos elétricos e magnéticos oscilantes que transporta energia pelo espaço a uma velocidade de 3 x 10 8 m/s.
A luz, é um tipo de radiação eletromagnética, consiste em campos elétricos e magnéticos oscilantes que transporta energia pelo espaço a uma velocidade de 3 x 10 8 m/s.
A luz tem características
ondulatórias semelhantes às ondas que se deslocam na água. Quando você observa
uma onda na superfície da água, é possível ver um padrão ondulatório de picos e
vales que se repetem periodicamente.
A distância entre dois picos da onda
é chamada de comprimento
de onda e é representado pela
letra λ (lambda). O número de ciclos ou
comprimentos de onda completos que passa por um ponto por unidade tempo
(segundo) é chamado de frequência da onda, representamos a frequência
pela letra ν (nu).
Assim como ocorre com as ondas na
água, podemos atribuir uma frequência e um comprimento de onda para a radiação
eletromagnética. A velocidade das ondas do mar pode variar, mas a velocidade da
onda eletromagnética é sempre constante e igual a 3 x 10 8 m/s.
Tipos de Radiação Eletromagnética.
Existem vários tipos de radiação
eletromagnética, como por exemplo, as ondas de rádio, as micro-ondas, o
infravermelho, a luz visível, o ultravioleta, os raios X, os raios gama e até
os raios cósmicos. Todos esses tipos de radiação eletromagnética, formam o que
os químicos chamam de Espectro Eletromagnético.
Mas, fica a pergunta, o que diferencia um tipo de radiação de ouro? A resposta são os diferentes tipos de comprimentos de ondas. Isso porque a frequência e o comprimento de onda da radiação eletromagnética estão sempre relacionados de um modo inverso. Ou seja, se a frequência de uma onda for alta (muitos ciclos por segundo) a onda terá comprimentos cada vez mais curtos, por outro lado, se a frequência for baixa (menos ciclos por segundo) os comprimentos de onda devem ser cada vez maiores. Essa relação pode ser perfeitamente expressar pela equação abaixo.
Mas, fica a pergunta, o que diferencia um tipo de radiação de ouro? A resposta são os diferentes tipos de comprimentos de ondas. Isso porque a frequência e o comprimento de onda da radiação eletromagnética estão sempre relacionados de um modo inverso. Ou seja, se a frequência de uma onda for alta (muitos ciclos por segundo) a onda terá comprimentos cada vez mais curtos, por outro lado, se a frequência for baixa (menos ciclos por segundo) os comprimentos de onda devem ser cada vez maiores. Essa relação pode ser perfeitamente expressar pela equação abaixo.
λ . ν = c
O espectro eletromagnético.
O espectro eletromagnético é um
espectro que mostra os vários tipos de radiação eletromagnética dispostos em ordem
crescente de comprimento de onda e decrescente de frequências. Quando você
observa com atenção um espectro eletromagnético, acaba percebendo que a faixa
de comprimentos de ondas da luz visível que vai de 400nm a 750nm é apenas uma
parte, uma pequena porção do espetro. A unidade de comprimentos de onda depende
do tipo de radiação. Por exemplo, para comprimentos longos (baixa frequência)
pode ser usado o centímetro (cm) ou o micrometro (µm). Para a luz visível, é usado o nanômetro (nm) e para
comprimentos de onda muito pequenos podemos usar o picnômetro (pm).
No espectro da luz visível, cada
comprimento de onda está associado a uma cor do arco-íris. Assim, o comprimento
de onda de 700 nm – 750 nm nos diz que o espetro está emitindo a cor vermelha,
620 nm a cor laranja, 580nm a cor amarela, 530nm verde, 470 nm azul e 400 nm –
420 a cor violeta.
O espectro atômico.
Já conhecemos as propriedades
eletromagnéticas, agora podemos usá-las para estudar a estrutura dos átomos,
uma vez que elas nos dão informações importantes a esse respeito.
Quando fazemos passar a luz branca ou
normal por um prisma, o resultado é um espectro continuo da luz formado por todos os
comprimentos de onda da luz
visível.
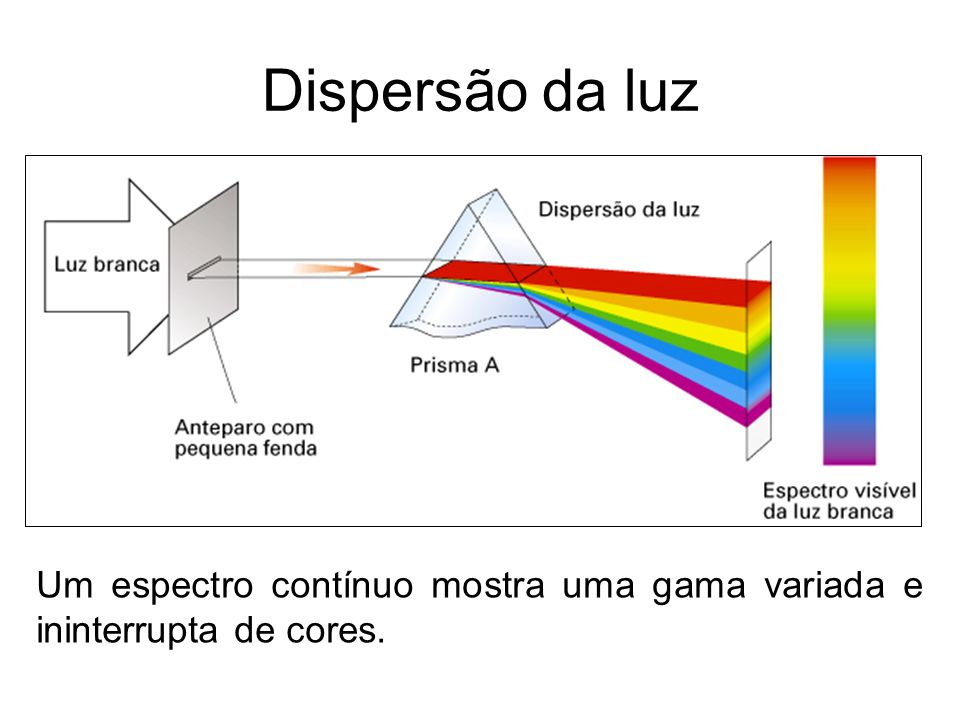 |
| Foto: https://slideplayer.com.br/slide/9297967/ |
| Foto: http://www.conecteeducacao.com |
Ao fazermos passar uma corrente
elétrica por um tubo de vidro contendo gás hidrogênio a baixa pressão, o gás
começa a emitir luz, pois os átomos de hidrogênio são estimulados a energias
mais altas (o gás hidrogênio é usado como exemplo por ser um átomo mais simples).
Quando essa luz emitida pelo gás passa por um prisma o resultado é um espectro com um
número especifico de linhas espectrais, onde cada uma das linhas apresenta
ou brilha em uma cor específica com seu respectivo comprimento de onda. Por
exemplo, o espetro do átomo de hidrogênio apresenta quatro (04) linhas. A linha
vermelha tem comprimento de onda de 656 nm, a linha verde bilha em 486nm, a
azul 434 nm e a linha violeta 410 nm.
| Foto: https://encrypted-tbn0.gstatic.com |
Bohr foi o primeiro cientista a
trazer um entendimento bem-sucedido sobre as linhas espectrais e uma importante
contribuição para o entendimento da estrutura atômica, principalmente sobre o
comportamento dos elétrons.
O entendimento sobre as linhas
espectrais no espetro do átomo de hidrogênio é que cada uma delas provém de uma
transição entre dois níveis de energia permitidos no átomo. Assim, um elétron
em um átomo só pode ter certas energias. Logo, a radiação ou luz emitida pelo átomo
e observada no espectro pelos comprimentos de onda é o resultado da transição de
um elétron de um nível de energia para outro, ou seja, da diferença de energia
entre esses dois níveis.
Como cada átomo tem um espectro de linhas
específico, assim, é a partir do espectro atômico que os átomos são identificados
e organizados na tabela periódica.
| Foto: https://encrypted-tbn0.gstatic.com/i |
