Tópicos
da postagem:
1. Os
filósofos gregos e a noção de átomo.
2. O
ressurgimento da noção de átomo.
3. Dalton
e a sua teoria atômica.
4. O modelo
de átomo imaginado por Dalton.
5. O Modelo do Pudim de Ameixa de Thomson e Modelo de Rutherford.
6. Modelo de átomo proposto por Bohr.
5. O Modelo do Pudim de Ameixa de Thomson e Modelo de Rutherford.
6. Modelo de átomo proposto por Bohr.
1. Os filósofos gregos e a noção de átomo.
 |
| Filósofos gregos Leucipo e Demócrito |
O conceito de átomo remota desde os tempos da Grécia antiga. Os filósofos gregos Leucipo e Demócrito acreditavam que a matéria era constituída de minúsculas partículas indivisíveis, as quais foram denominadas de átomo, do grego, que significa indivisível.
Mas tarde,
Platão e Aristóteles formularam a noção de que, não poderia existir partículas indivisíveis.
Como eles eram os filósofos mais conceituados da época, a noção de átomo focou
abandonada por muitos séculos, até ressurgir novamente em meados do século XVII
e XVIII.
2. O ressurgimento da noção de átomo.
A noção
de átomo ressurgiu quando os químicos começaram a fazer medições da matéria, ao
observarem as quantidades de elementos que reagiam com outros elementos para
formar novas substâncias ou os compostos. Nesse cenário, as leis da conservação
das massas do químico Lavoisier (a matéria não pode ser destruída, mas se
conserva) e a lei das proporções constantes do químico Proust (a proporção em
massa dos elementos que participam de uma reação química permanece sempre
constante) foram de fundamental importância para realização dos cálculos de medição
e previsão estequiométrica das massas das substâncias antes e depois de uma reação
química.
3. Dalton e a sua teoria atômica.
 |
| John Dalton |
Dalton,
utilizou a lei da conservação da massa de Lavoisier e a lei das proporções constantes
de Proust para elaborar a sua famosa teoria atômica – conhecida como a Teoria atômica
de Dalton. Sua teoria atômica pode assim ser resumida:
- Toda a matéria é formada de minúsculas partículas
chamadas de átomo.
- Átomos
do mesmo elemento são iguais e têm massas iguais. Átomos de elementos
diferentes são diferentes e tem massas diferentes.
-
Átomos não são criados e nem destruídos em uma reação química.
- Os átomos
se combinam para formar os compostos ou novas substancias.
4. O modelo de átomo imaginado por Dalton
Após formular
a sua teoria atômica, Dalton pôde imaginar uma espécie de modelo atômico para
representar o átomo. Segundo ele, o átomo então seria uma esfera maciça, impenetrável
e indivisível, sem nenhuma natureza elétrica. O modelo de átomo imaginado por Dalton
é semelhante a uma bola de bilhar (logicamente em proporções minúsculas).
Dalton
e os que vieram depois dele, não tinham qualquer evidencia concreta da existência
de átomos. Hoje, com a descoberta da estrutura atômica, sabemos que o átomo é constituído
de prótons, eletros e neutros. E, com equipamentos adequados, podemos até tirar
foto dele.
5. O Modelo do Pudim de Ameixa de Thomson e Modelo de Rutherford
Até esse ponto,
acreditava-se que os átomos eram as menores unidades de matéria. Em 1897,
JJ Thomson descobriu o elétron. Ele acreditava que os átomos poderiam ser
divididos. Como o elétron carregava uma carga negativa, ele propôs um
modelo do átomo de pudim de ameixa, no qual os elétrons estavam embutidos em
uma massa de carga positiva para produzir um átomo eletricamente neutro.
Ernest Rutherford,
um dos estudantes de Thomson, desaprovou o modelo do pudim de ameixa em 1909.
Rutherford descobriu que a carga positiva de um átomo e a maior parte de sua
massa estavam no centro, ou núcleo, de um átomo. Ele descreveu um modelo
planetário no qual os elétrons orbitam um pequeno núcleo de carga positiva.
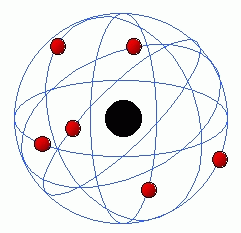
6. Modelo de átomo proposto por Bohr.
Rutherford estava no caminho certo, mas seu modelo não conseguia explicar os espectros de emissão e absorção dos átomos, nem por que os elétrons não colidiram com o núcleo. Em 1913, Niels Bohr propôs o modelo de Bohr, que afirma que os elétrons apenas orbitam o núcleo a distâncias específicas do núcleo. Segundo seu modelo, os elétrons não poderiam entrar em espiral no núcleo, mas poderiam fazer saltos quânticos entre os níveis de energia.
FONTE
[1] Química A Ciência Central - Resumo feito pelo Prof José Ribamar.
[2] Helmenstine, Anne Marie, Ph.D. "Uma breve história
da teoria atômica". ThoughtCo. https://www.thoughtco.com/history-of-atomic-theory-4129185
(acessado em 7 de fevereiro de 2019)




:max_bytes(150000):strip_icc():format(webp)/atomic-structure-conceptual-artwork-99312661-58af58c75f9b5860467ff472.jpg)

Excelente abordagem, parabens
ResponderExcluirGrato!
ExcluirObrigado professor. O objetivo da produção das postagens é usa-las como artigos de apoio em minhas aulas de Química.